![]()
J. Korean Inst. Electr. Electron. Mater. Eng. Vol. 37, No. 2, pp. 215-222 March 2024
doi: https://doi.org/10.4313/JKEM.2024.37.2.14
ISSN 1226-7945(Print), 2288-3258(Online)
공침법을 통한 나노로드 형태의 니켈계 양극 소재 개발에 관한 연구
계명대학교 화공신소재공학부 신소재공학전공
A Study on the Development of Nanorod-Type Ni-Rich Cathode Materials by Using Co-Precipitation Method
Department of Advanced Materials Engineering, Keimyung University, Daegu 42601, Korea
(Received December 28, 2023; Revised January 3, 2024; Accepted January 8, 2024)
Abstract
Ni-rich cathode materials have been developed as the most promising candidates for next-generation cathode materials for lithium-ion batteries because of their high capacity and energy density. In particular, the electrochemical performance of lithium-ion batteries could be enhanced by increasing the contents of nickel ion. However, there are still limitations, such as low structural stability, cation mixing, low capacity retention and poor rate capability. Herein, we have successfully developed the nanorod-type Ni-rich cathode materials by using co-precipitation method. Particularly, the nanorod-type primary particles of LiNi0.7Co0.15Mn0.15O2 could facilitate the electron transfer because of their longitudinal morphology. Moreover, there were holes at the center of secondary particles, resulting in high permeability of the electrolyte. Lithium-ion batteries using the prepared nanorod-type LiNi0.7Co0.15Mn0.15O2 achieved highly improved electrochemical performance with a superior rate capability during battery cycling.
Keywords: Lithium-ion batteries, Ni-rich cathode, Co-precipitation, Nanorod, Hollow structure
✉ Joohyuk Park; jhpark@kmu.ac.kr
Copyright ©2024 KIEEME. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
1. 서 론
최근 다양한 전자기기의 무선화가 급속도로 진행되면서 에너지 저장 및 변환 시스템 개발에 관한 수요가 증가하고 있다 [1,2]. 특히 친환경적이며 지속 가능한 에너지 저장 시스템들이 각광을 받고 있으며 그중 리튬 이온 전지는 우수한 충·방전 성능을 바탕으로 지속적인 연구가 이루어지고 있다 [3-5]. 리튬 이온 전지를 구성하고 있는 양극, 음극, 전해액 및 분리막 모두 중요한 요소들이며 각각의 특성을 향상시키는 데 많은 연구자들이 노력하고 있다 [6-9]. 그중에서도 양극 소재는 리튬 이온 전지의 가격과 전기화학 특성을 결정짓는 중요한 요소이기 때문에 꾸준히 개발이 진행되고 있으며 앞으로도 발전 가능성이 무궁무진하다 [10]. 기존에 전이금속층이 코발트로만 구성되어 있는 층상형 양극 소재인 LiCoO2의 경우, 우수한 전기화학 특성과 구조적 안정성을 바탕으로 대표적인 리튬 이온 전지용 양극 소재로 각광을 받았다 [11]. 하지만 리튬 이온이 50% 이상 층상형 구조에서 빠져나올 경우, O3 구조가 P3 구조로 변화하며 비가역적인 용량을 나타내는 문제점이 발생하였다 [12,13]. 이러한 문제로 인하여 우수한 이론 용량(274 mAh g-1)을 가지고 있음에도 불구하고 실제 사용 가능한 가역 용량은 145 mAh g-1밖에 나타내지 못하였다. 따라서 리튬 이온 전지용 양극 활물질의 가역 용량을 향상시키기 위한 연구가 활발히 진행되고 있다 [14].
니켈계 양극 소재는 우수한 충·방전 성능과 높은 에너지 밀도를 바탕으로 차세대 리튬 이온 전지용 양극 소재로 각광을 받고 있다. 특히 니켈의 우수한 전기화학적 특성을 기반으로 니켈, 코발트 및 망간 이온으로 구성된 NCM 양극 소재 내부의 니켈 함량을 증가시켜 리튬 이온 전지의 전기화학 특성을 향상시키는 연구가 활발히 진행되고 있다 [15-19]. 기존의 LiCoO2는 전이금속층이 코발트 이온으로만 구성되어 있으나 NCM 양극 활물질은 코발트 이온뿐만 아니라 니켈 이온과 망간 이온을 포함하고 있다. 이때, 망간 이온은 양극 소재의 층상형 구조를 유지하는 데 기여를 하며 니켈은 에너지 밀도를 향상시키는 역할을 한다. 특히, 리튬 이온 전지의 전기화학 성능을 향상시키기 위해서는 에너지 밀도를 향상시키는 니켈 이온의 함량을 적절히 향상시키는 것이 중요하다. 니켈 이온의 경우, 기존 코발트 이온만 포함하고 있는 LiCoO2에서 충전 시 50% 이상의 리튬 이온이 빠져나갈 때 상 전이가 발생하는 것과는 달리 리튬 이온이 70% 이상 빠져나갈 경우 상전이가 발생하게 된다 [20]. 따라서 리튬 이온 전지의 충·방전 과정 중 활용할 수 있는 리튬 이온의 수가 많아지므로 가역 용량을 향상시킬 수 있으며 실제 NCM 양극 소재의 가역 용량은 170 mAh g-1 전후로 나타내고 있다. 하지만 니켈의 함량이 증가함에 따라 발생하는 구조적 불안정성으로 인하여 충·방전 시 전기화학 특성이 감소하는 문제점이 여전히 해결되지 못하고 있다 [21]. 특히 양극 활물질의 층상형 구조 내에 존재하는 Ni3+ 이온의 전자배치는 저스핀 d7이므로 Ni2+ 및 Ni4+ 이온에 비하여 불안정하다. 따라서 NCM 양극 소재에 포함되어 있는 니켈 이온은 Ni3+뿐만 아니라 Ni2+ 및 Ni4+ 이온을 포함하게 된다. 이때, Ni2+의 이온 반지름은 0.69 Å으로 0.76 Å인 Li+와 매우 유사하기 때문에 합성 과정이나 리튬 이온 전지의 충·방전이 진행됨에 따라 리튬 이온 자리를 니켈 이온이 차지하는 양이온 혼합이 일어나게 된다 [22]. 이러한 양이온 혼합은 NCM 양극 소재의 표면 구조 안정성을 저하시키고 충·방전 시 구조 변화에 따른 전기화학 특성 저하를 일으키는 원인이다 [23]. 현재 이러한 문제점을 해결하기 위한 코팅 및 도핑 기반의 표면 처리나 입자 형태 조절과 같은 다양한 연구가 진행되고 있다.
NCM 양극 소재와 같은 금속 산화물 구조를 합성하기 위해서는 물질 내에 포함되어 있는 각 원소별 전구체들을 균일하게 혼합하는 것이 필수적이다. 일반적으로 다양한 전구체들을 고상에서 혼합하는 고상 합성법의 경우, 다양한 원소를 균일하게 혼합하는 데 다소 한계가 있다. 이러한 문제점으로 인하여 전이금속들 간의 비율이 목표치에 다소 벗어나거나 열처리 과정 중 각 전이금속 기반의 산화물과 같은 불순물이 함께 합성되는 현상이 발생하기도 한다. 따라서 NCM 양극 소재 내에 포함된 니켈, 코발트 및 망간 이온과 같은 다양한 이온들을 균일하게 혼합하고 동시에 침전시킬 수 있는 공침법은 가장 대표적인 리튬 이온 전지용 양극 활물질 합성법이다 [24,25]. 본 연구에서는 공침법을 통하여 LiNi0.7Co0.15Mn0.15O2 소재의 일차입자 및 이차입자의 크기와 형태를 조절하여 리튬 이온 전지의 전기화학 특성을 향상시키는 연구를 진행하였다. 다양한 공침 조건 중 반응 온도를 조절하며 나노로드 형태의 일차입자로 구성된 이차입자 Ni0.7Co0.15Mn0.15(OH)2 전구체를 합성하였다. 특히 고온에서 합성한 전구체를 활용한 나노로드 형태의 LiNi0.7Co0.15Mn0.15O2 이차입자 내부에 hole이 존재하는 것을 확인하였다. 이러한 hollow 구조는 이차입자 내부로 전해액 침투를 용이하게 하여 LiNi0.7Co0.15Mn0.15O2의 용량을 향상시키고 우수한 고속 충·방전 성능에 기여하는 것을 밝혀냈다.
2. 실험 방법
2.1 시료 합성
LiNi0.7Co0.15Mn0.15O2를 합성하기 위하여 일반적인 공침법을 사용하였다. 먼저 각 전이금속 이온들이 0.7:0.15: 0.15의 몰 비율로 혼합된 용액을 만들기 위하여 황산니켈 6수화물(NiSO4·6H2O), 황산코발트 7수화물(CoSO4·7H2O) 및 황산망간 6수화물(MnSO4·6H2O)을 전구체로 활용하였다. 또한 2.0 M의 수산화 나트륨 용액과 0.2 M의 암모니아수를 준비한다. 준비한 전이금속 용액, 수산화 나트륨 용액 및 암모니아수를 각각 300, 280 그리고 30 mL h-1의 속도로 4 L 용량의 공침용 반응기에 투입한다. 공침 시 반응 용기의 온도는 Ni0.7Co0.15Mn0.15(OH)2 전구체의 형태를 조절하기 위하여 저온인 50℃와 고온인 70℃에서 각각 진행하였다. 상대적으로 저온인 50℃에서 합성을 진행한 전구체는 LT-Ni0.7Co0.15Mn0.15(OH)2라 명명하였고 고온인 70℃에서 합성을 진행한 전구체는 HT-Ni0.7Co0.15Mn0.15(OH)2라 명명하였다. 두 전구체의 합성은 모두 18시간 동안 진행하였다. 합성된 전구체는 리튬 이온 전지용 양극 활물질 합성을 위하여 수산화리튬(LiOH·H2O)과 1:1.03의 비율로 혼합되어 820℃에서 15시간 동안 열처리를 진행하였다. 최종적으로 LT-Ni0.7Co0.15Mn0.15(OH)2을 이용하여 합성한 LT-LiNi0.7 Co0.15Mn0.15O2와 HT-Ni0.7Co0.15Mn0.15(OH)2을 이용하여 합성한 HT-LiNi0.7Co0.15Mn0.15O2를 얻었다.
2.2 전기화학 특성평가
본 연구에 사용한 모든 반쪽 전지는 2032R 형태의 코인셀을 활용하여 조립하였다. 양극 전극은 양극 활물질(96 wt%), Super-P (2 wt%), 플루오르화 폴리비닐리덴 바인더(2 wt%)를 혼합하여 제작하였다. 양극의 로딩 레벨은 약 12 mg cm-2이며 합재 밀도는 약 3.0 g cm-3이다. 전해액은 탄산 에틸렌 및 탄산 에틸 메틸 용매 내에 1 M의 육불화인산리튬이 녹아 있는 유기 용매를 사용하였다. 분리막은 폴리프로필렌과 폴리에틸렌으로 구성된 25 μm 두께의 미세 다공성 막을 사용하였다. 반쪽 전지의 조립은 아르곤으로 채워진 글러브 박스를 이용하였다. 양극 반쪽 전지의 전기화학 평가는 3.0에서 4.3 V 전압 구간 내에서 정전류-정전압 모드로 진행하였다. 첫 번째 충·방전 사이클 평가는 0.1 C의 속도로 진행하였다. 충·방전 속도에 따른 용량 분석을 위하여 0.1 C, 0.5 C, 1 C, 2 C 및 4 C와 같은 다양한 방전 속도 평가를 진행하였으며 이때, 충전 속도는 0.5 C로 동일하게 유지하였다.
2.3 구조 분석
LT-LiNi0.7Co0.15Mn0.15O2 및 HT-LiNi0.7Co0.15Mn0.15O2의 결정 구조를 분석하기 위하여 X-ray diffraction (XRD) 분석을 진행하였다. XRD는 Rigaku사의 D/MAX 2500을 활용하였으며 X-선은 Cu Kα 선을 사용하였다. LT-LiNi0.7Co0.15Mn0.15O2 및 HT-LiNi0.7Co0.15Mn0.15O2의 일차입자 및 이차입자 형태를 분석하기 위하여 SEM 분석을 진행하였다. SEM은 FEI사의 Verios 460을 활용하였다. LiNi0.7Co0.15Mn0.15O2 이차입자 내부에 위치한 hole의 존재 여부를 관찰하기 위하여 FIB 분석을 진행하였다. FIB는 FEI사의 Helios Nanolab 450을 활용하였다.
3. 결과 및 고찰
먼저 LiNi0.7Co0.15Mn0.15O2 소재의 일차입자 크기 및 형태를 조절하기 위하여 Ni0.7Co0.15Mn0.15(OH)2 전구체 최적화를 진행하였다. Ni0.7Co0.15Mn0.15(OH)2 전구체 합성을 위한 공침을 진행할 때, 다양한 조건을 조절할 수 있다. 표 1은 나노로드 형태의 일차입자로 구성된 이차입자 Ni0.7Co0.15Mn0.15(OH)2 전구체를 합성하기 위한 다양한 조건을 나타낸 표이다. 크게 두 가지 조건을 활용하여 Ni0.7Co0.15Mn0.15(OH)2 전구체를 합성을 진행하였다. 공침 시 반응 조건은 크게 교반 속도, pH, 온도 그리고 가스 종류로 구성된다. 교반 속도의 경우, 기존에 최적화된 1,200 rpm의 속도에서 일차입자 형성 및 이차입자 성장을 진행하였으며 반응 시 용액의 pH도 두 조건 모두 11로 일정하게 유지하였다. 또한 합성에 사용된 가스는 비활성 기체인 질소를 동일하게 사용하였으며 반응 시 온도 조건만 50℃ 및 70℃로 각각 다르게 진행하였다. 즉 조건 1의 경우, 상대적으로 저온인 50℃에서 침전반응이 진행되었고 조건 2는 상대적으로 고온인 70℃에서 침전이 진행되었다.
이와 같은 공침 조건의 경우, 나노로드 형태의 일차입자를 형성하는 데 가장 적합하였기 때문에 해당 조건을 활용하여 합성을 진행하게 되었다. 또한 반응 용기 온도의 경우, 나노로드 형태의 일차입자가 뭉치면서 형성하는 이차입자의 형태를 조절하는 데 중요한 역할을 하기 때문에 저온과 고온으로 나누어서 진행하게 되었다. 다음과 같이 저온과 고온 합성을 통하여 최종적으로 나노로드 형태의 일차입자로 구성된 Ni0.7Co0.15Mn0.15(OH)2 전구체의 이차입자 중심에 hole을 형성하여 전해액 침투를 용이하게 함으로써 전기화학 특성을 향상시키는 것이 본 연구의 최종적인 목표이며 이를 확인하기 위한 다양한 구조 분석을 진행하였다.
그림 1은 표 1에서 진행한 두 가지 공침 조건인 저온(50℃)과 고온(70℃)에서 합성한 Ni0.7Co0.15Mn0.15(OH)2 전구체의 형태를 분석하기 위한 SEM 결과이다. 저온에서 합성한 Ni0.7Co0.15Mn0.15(OH)2 전구체[LT-Ni0.7Co0.15Mn0.15(OH)2]의 이차입자는 구형의 형태를 나타내고 있으며 사이즈는 약 7 μm임을 확인하였다 [그림 1(a)]. 그림 1(b)는 LT-Ni0.7Co0.15Mn0.15(OH)2 전구체의 일차입자 형태를 분석하기 위하여 그림 1(a)를 확대한 결과이다. SEM 분석 결과에 따르면 LT-Ni0.7Co0.15Mn0.15(OH)2 전구체의 일차입자는 판상형이며 단면은 약 200~300 nm 길이의 나노로드 형태를 갖고 있다. 그림 1(c)는 고온에서 합성한 Ni0.7Co0.15Mn0.15 (OH)2 전구체[HT-Ni0.7Co0.15Mn0.15(OH)2]의 이차입자에 대한 SEM 분석 결과이다. HT-Ni0.7Co0.15Mn0.15(OH)2 전구체는 LT-Ni0.7Co0.15Mn0.15(OH)2 전구체와 동일하게 판상형의 일차입자로 구성된 약 7 μm 사이즈의 구형 이차입자를 갖고 있다. 다만, HT-Ni0.7Co0.15Mn0.15(OH)2 전구체의 일차입자 단면은 약 500 nm 길이의 나노로드 형태로 LT-Ni0.7Co0.15Mn0.15(OH)2 전구체에 비하여 일차입자 사이즈가 큰 것을 관찰하였다 [그림 1(d)]. 결과적으로 SEM 분석을 통하여 저온 및 고온에서 합성한 Ni0.7Co0.15Mn0.15(OH)2 전구체 모두 나노로드 형태의 일차입자로 구성된 이차입자가 성공적으로 형성된 것을 확인할 수 있었다.

Fig. 1. SEM images of Ni0.7Co0.15Mn0.15(OH)2 precursor based on different co-precipitation conditions: (a) SEM image and (b) its high magnification image of LT-Ni0.7Co0.15Mn0.15(OH)2 precursor, which was co-precipitated at low temperature (50℃), (c) SEM image and (d) its high magnification image of HT-Ni0.7Co0.15Mn0.15(OH)2 precursor, which was co-precipitated at high temperature (70℃).
저온과 고온에서 합성한 LT-Ni0.7Co0.15Mn0.15(OH)2 및 HT-Ni0.7Co0.15Mn0.15(OH)2 전구체를 활용하여 나노로드 형태의 LiNi0.7Co0.15Mn0.15O2 합성을 진행하였다. 합성은 모두 산소 분위기에서 진행되었으며 820℃에서 15시간 동안 열처리를 진행하였다. 그림 2(a)는 저온에서 합성한 Ni0.7Co0.15Mn0.15(OH)2 전구체를 활용하여 얻은 LiNi0.7Co0.15Mn0.15O2 (LT-LiNi0.7Co0.15Mn0.15O2)에 대한 XRD 분석 결과이다. XRD 분석을 통하여 LT-LiNi0.7Co0.15Mn0.15O2는 R-3m 공간군의 일반적인 층상형 구조를 갖고 있는 것을 성공적으로 확인하였다. 고온에서 공침을 진행한 Ni0.7Co0.15Mn0.15(OH)2 전구체를 활용하여 합성한 LiNi0.7Co0.15Mn0.15O2 (HT-LiNi0.7Co0.15Mn0.15O2)에 대한 XRD 분석 결과는 그림 2(b)를 통해 확인할 수 있다. HT-LiNi0.7Co0.15Mn0.15O2 역시 LT-LiNi0.7Co0.15Mn0.15O2와 마찬가지로 R-3m 공간군을 가진 층상형 구조를 갖고 있다. 특히 두 물질 모두 우수한 결정성을 나타내고 있으며 불순물 없이 순수한 NCM 양극 소재가 성공적으로 합성되었다.
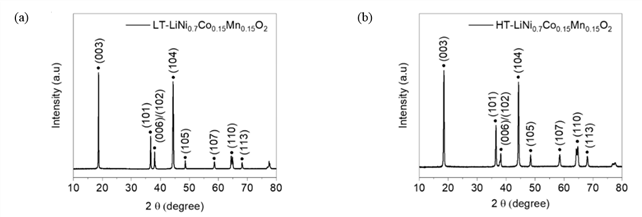
Fig. 2. Powder XRD patterns of nanorod-type LiNi0.7Co0.15Mn0.15O2 based on different co-precipitation conditions: (a) powder XRD pattern of nanorod-type LT-LiNi0.7Co0.15Mn0.15O2 and (b) powder XRD pattern of nanorod-type HT-LiNi0.7Co0.15Mn0.15O2.
한 가지 흥미로운 점은 LT-LiNi0.7Co0.15Mn0.15O2 및 HT-LiNi0.7Co0.15Mn0.15O2의 XRD 분석 결과에 차이가 있다는 것이다. 두 물질 모두 층상형 구조 기반의 NCM 양극 소재이나 (003)면과 (104)면에 해당하는 피크 세기의 비율인 I(003)/I(104) 값이 다르다. 이러한 차이는 NCM 양극 활물질을 구성하는 니켈 이온들 중 Ni2+ 이온이 이온 반지름이 유사한 Li+ 이온 자리를 차지하는 양이온 혼합의 정도에 의해 결정된다. 특히 양이온 혼합이 일어나게 되면 NiO 형태의 암염구조가 형성되면서 I(003)/I(104) 값이 감소하게 된다. XRD 분석 결과에 따르면 LT-LiNi0.7Co0.15Mn0.15O2 및 HT-LiNi0.7Co0.15Mn0.15O2의 I(003)/I(104) 값은 각각 1.10과 1.14임을 확인할 수 있다. 따라서 합성 과정 중 HT-LiNi0.7Co0.15Mn0.15O2이 LT-LiNi0.7Co0.15Mn0.15O2에 비하여 양이온 혼합이 더 적게 일어난 것을 알 수 있다. 이러한 두 물질 간의 구조적인 차이는 리튬 이온 전지의 충·방전 과정 중 나타내는 전기화학 특성에 영향을 미칠 것이다.
그림 3은 저온과 고온에서 합성한 LT-LiNi0.7Co0.15Mn0.15O2 및 HT-LiNi0.7Co0.15Mn0.15O2의 형태를 분석하기 위한 SEM 및 FIB 결과이다. 저온에서 합성한 LT-LiNi0.7Co0.15Mn0.15O2의 이차입자는 구형의 형태를 나타내고 있으며 사이즈는 약 9 μm임을 확인하였다 [그림 3(a)]. 그림 3(b)는 LT-LiNi0.7Co0.15Mn0.15O2의 일차입자 형태와 이차입자 내부 구조 분석을 위하여 이차입자의 FIB 밀링을 진행한 결과이다. 이차입자 단면 분석 결과에 따르면 LT-LiNi0.7Co0.15Mn0.15O2의 일차입자 단면은 약 200~300 nm 길이의 나노로드 형태를 나타내고 있다. 또한 LT-LiNi0.7Co0.15Mn0.15O2의 이차입자 내부에서는 특징적인 구조를 관찰하지 못하였으며 나노로드 형태의 일차입자들이 밀도 있게 뭉쳐 있는 것을 확인하였다.

Fig. 3. SEM and FIB images of nanorod-type LiNi0.7Co0.15Mn0.15O2 based on different co-precipitation conditions: (a) SEM and (b) FIB images of nanorod-type LT-LiNi0.7Co0.15Mn0.15O2 based on LT-Ni0.7Co0.15Mn0.15(OH)2 precursor, which was co-precipitated at low temperature (50℃), (c) SEM and (d) FIB images of nanorod-type HT-LiNi0.7Co0.15Mn0.15O2 based on HT-Ni0.7Co0.15Mn0.15(OH)2 precursor, which was co-precipitated at high temperature (70℃).
그림 3(c)는 고온에서 합성한 HT-LiNi0.7Co0.15Mn0.15O2의 이차입자에 대한 SEM 분석 결과이다. HT-LiNi0.7Co0.15Mn0.15O2는 LT-LiNi0.7Co0.15Mn0.15O2와 동일하게 나노로드 형태의 일차입자로 구성된 약 9 μm 사이즈의 구형 이차입자를 갖고 있다. 다만, HT-LiNi0.7Co0.15Mn0.15O2의 이차입자 내부에는 LT-LiNi0.7Co0.15Mn0.15O2와 다르게 약 1 μm 사이즈의 hole이 존재하는 것을 관찰하였다 [그림 3(d)]. 결과적으로 SEM 및 FIB 분석을 통하여 저온 및 고온에서 합성한 LT-LiNi0.7Co0.15Mn0.15O2 및 HT-LiNi0.7Co0.15Mn0.15O2 모두 나노로드 형태의 일차입자로 구성된 이차입자가 형성된 것을 관찰하였으며 특히 HT-LiNi0.7Co0.15Mn0.15O2는 이차입자 내에 hole이 존재하는 hollow 구조를 갖고 있는 것을 성공적으로 확인하였다.
그림 4는 고온에서 합성한 HT-LiNi0.7Co0.15Mn0.15O2에 존재하는 다양한 이차입자들의 내부 구조를 분석하기 위한 FIB 결과이다. 이전의 SEM 및 FIB 분석 결과에 따르면 HT-LiNi0.7Co0.15Mn0.15O2의 이차입자는 내부에 hole이 존재하는 hollow 구조를 갖고 있다. 하지만 많은 이차입자들 중 일부 입자만 가지고 있는 특징일 수 있으므로 hollow 구조가 HT-LiNi0.7Co0.15Mn0.15O2의 이차입자들 내에 균일하게 존재하는지 확인하기 위하여 추가 분석을 진행하였다. 그림 4(a)는 HT-LiNi0.7Co0.15Mn0.15O2에 존재하는 임의의 이차입자 1 (HT-LiNi0.7Co0.15Mn0.15O2-1)에 대한 FIB 밀링 결과이다. 이차입자 단면 분석 결과에 따르면 HT-LiNi0.7Co0.15Mn0.15O2-1는 나노로드 형태의 일차입자를 나타내고 있으며 이차입자 중심에 약 1 μm 사이즈의 hole이 존재하는 hollow 구조를 갖고 있다 [그림 4(b)]. 그림 4(c)는 HT-LiNi0.7Co0.15Mn0.15O2에 존재하는 임의의 이차입자 2 (HT-LiNi0.7Co0.15Mn0.15O2-2)에 대한 FIB 밀링 결과이다. 이차입자 단면 분석 결과에 따르면 HT-LiNi0.7Co0.15Mn0.15O2-2는 나노로드 형태의 일차입자를 나타내고 있으며 HT-LiNi0.7Co0.15Mn0.15O2-1과 동일하게 이차입자 중심에 약 1 μm 사이즈의 hole이 존재하고 있다 [그림 4(d)]. 따라서 HT-LiNi0.7Co0.15Mn0.15O2의 이차입자들 내에 hole이 존재하는 hollow 구조가 균일하게 합성된 것을 확인하였다.

Fig. 4. FIB images of nanorod-type HT-LiNi0.7Co0.15Mn0.15O2 based on HT-Ni0.7Co0.15Mn0.15(OH)2 precursor, which was co-precipitated at high temperature (70℃) [FIB images and their high magnification images for holes at the center of various secondary particles of nanorod-type HT-LiNi0.7Co0.15Mn0.15O2 including (a, b) particle 1 and (c, d) particle 2, respectively].
그림 5는 나노로드 형태의 LT-LiNi0.7Co0.15Mn0.15O2와 HT-LiNi0.7Co0.15Mn0.15O2의 전기화학 특성을 평가한 결과이다. 충·방전 특성 평가는 2032R 형태의 코인셀 기반의 반쪽 전지를 활용하였으며 전극의 로딩 레벨은 약 12 mg cm-2이며 합재 밀도는 약 3.0 g cm-3이다. 또한 모든 양극 반쪽 전지의 전기화학 평가는 3.0에서 4.3 V 전압 구간 내에서 정전류-정전압 모드로 진행하였다. LT-LiNi0.7Co0.15Mn0.15O2와 HT-LiNi0.7Co0.15Mn0.15O2의 첫 번째 충·방전 사이클 평가는 0.1 C의 속도로 진행하였다 [그림 5(a)]. LT-LiNi0.7Co0.15Mn0.15O2의 충전 및 방전 용량은 각각 ~204 mAh g-1 및 ~181 mAh g-1이며 쿨롱 효율은 ~89%를 나타냈다. HT-LiNi0.7Co0.15Mn0.15O2의 충전 및 방전 용량은 각각 ~203 mAh g-1 및 ~185 mAh g-1이며 쿨롱 효율은 ~91%를 나타냈다. 두 물질 모두 유사한 충전 용량을 보여주고 있으나 HT-LiNi0.7Co0.15Mn0.15O2의 방전용량이 LT-LiNi0.7Co0.15Mn0.15O2에 비하여 우수하며 결과적으로 더 높은 쿨롱 효율을 나타내고 있다.
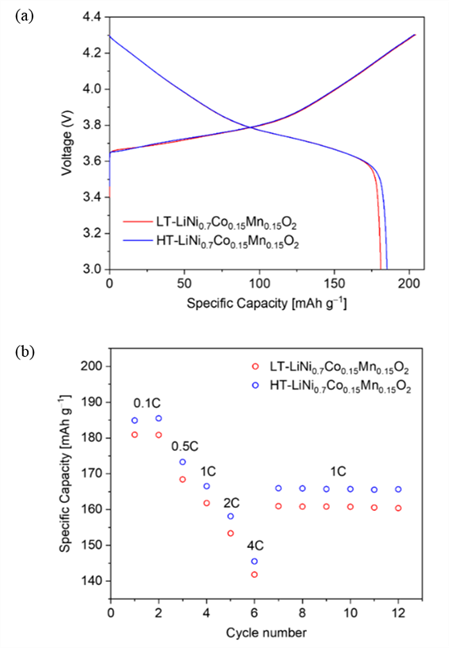
Fig. 5. Electrochemical performance of nanorod-type LiNi0.7Co0.15 Mn0.15O2 based on different co-precipitation conditions: (a) first cycle voltage profiles of the LT-LiNi0.7Co0.15Mn0.15O2 and HT-LiNi0.7Co0.15Mn0.15O2, where the operating voltage ranged from 3.0 to 4.3 V. The charge and discharge C-rate were 0.1 C and (b) rate performance of the LT-LiNi0.7Co0.15Mn0.15O2 and HT-LiNi0.7Co0.15Mn0.15O2 at 25°C, where the operating voltage ranged from 3.0~4.3 V (the discharge C-rate increased from 0.1 to 4 C with a fixed charge rate of 0.5 C).
그림 5(b)는 충·방전 속도에 따른 LT-LiNi0.7Co0.15Mn0.15O2와 HT-LiNi0.7Co0.15Mn0.15O2의 용량 분석을 위하여 다양한 방전 속도 평가를 진행한 결과이다. 이때, 방전 속도는 0.1, 0.5, 1, 2 및 4 C이며 충전 속도는 0.5 C로 동일하게 유지하였다. LT-LiNi0.7Co0.15Mn0.15O2의 방전 용량은 0.1, 0.5, 1, 2 및 4 C 속도에서 각각 ~181, ~168, ~161, ~153 및 ~141 mAh g-1을 나타냈다. HT-LiNi0.7Co0.15Mn0.15O2의 방전 용량은 0.1, 0.5, 1, 2 및 4 C 속도에서 각각 ~185, ~173, ~166, ~158 및 ~146 mAh g-1을 나타냈다. 실험을 진행한 모든 방전 속도에 대하여 HT-LiNi0.7Co0.15Mn0.15O2의 방전 용량이 LT-LiNi0.7Co0.15Mn0.15O2보다 우수하였으며 특히 고율 방전 시 안정적인 방전 용량을 나타내는 것을 확인하였다. 이러한 결과는 HT-LiNi0.7Co0.15Mn0.15O2의 이차입자 중심에 hole이 존재하는 hollow 구조가 입자 표면의 전해액이 내부로 침투하는 것을 용이하게 하여 이온 전도도를 향상시키기 때문이다. 따라서 두 물질 간의 전기화학 특성 차이는 LT-LiNi0.7Co0.15Mn0.15O2와 HT-LiNi0.7Co0.15Mn0.15O2의 이차입자 형태 차이로 인한 것임을 성공적으로 밝혀냈다.
4. 결 론
본 연구에서는 다양한 공침 조건 중 반응 온도를 조절하며 나노로드 형태의 일차입자로 구성된 LT-LiNi0.7Co0.15Mn0.15O2와 HT-LiNi0.7Co0.15Mn0.15O2 이차입자를 합성하여 구조 분석 및 전기화학 특성 평가를 진행하였다. 두 물질 모두 높은 결정성의 층상형 구조를 바탕으로 우수한 충·방전 성능을 나타냈다. 특히 고온에서 합성한 나노로드 형태의 HT-LiNi0.7Co0.15Mn0.15O2이 저온에서 합성한 LT-LiNi0.7Co0.15Mn0.15O2에 비하여 우수한 첫 번째 사이클 방전 용량 및 고율 방전 특성을 보였는데 이는 두 물질 간의 이차입자 내부 구조 차이에 의해 나타나는 것임을 성공적으로 밝혀냈다. LT-LiNi0.7Co0.15Mn0.15O2의 이차입자 내부는 나노로드 형태의 일차입자들이 밀도 있게 뭉쳐 있었다. 하지만 HT-LiNi0.7Co0.15Mn0.15O2의 경우, 이차입자 내에 hole이 존재하는 hollow 구조가 균일하게 합성되었다. 이러한 hollow 구조는 이차입자 내부로 전해액 침투를 용이하게 하여 HT-LiNi0.7Co0.15Mn0.15O2의 용량을 향상시키고 우수한 고속 충·방전 성능에 기여하는 것을 밝혀냈다.
ORCID
Joohyuk Park https://orcid.org/0000-0003-4366-6446
감사의 글
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea government (MSIT) (NRF-2021R1 F1A1045466).
REFERENCES
[1] M. Armand and J. M. Tarascon, Nature, 451, 652 (2008). doi: https://doi.org/10.1038/451652a![]()
[2] J. Liu, J. G. Zhang, Z. Yang, J. P. Lemmon, C. Imhoff, G. L. Graff, L. Li, J. Hu, C. Wang, J. Xiao, G. Xia, V. V. Viswanathan, S. Baskaran, V. Sprenkle, X. Li, Y. Shao, and B. Schwenzer, Adv. Funct. Mater., 23, 929 (2013). doi: https://doi.org/10.1002/adfm.201200690![]()
[3] A. Vlad, N. Singh, C. Galande, and P. M. Ajayan, Adv. Energy Mater., 5, 1402115 (2015). doi: https://doi.org/10.1002/aenm.201402115![]()
[4] B. Scrosati and J. Garche, J. Power Sources, 195, 2419 (2010). doi: https://doi.org/10.1016/j.jpowsour.2009.11.048![]()
[5] K. X. Wang, X. H. Li, and J. S. Chen, Adv. Mater., 27, 527 (2015). doi: https://doi.org/10.1002/adma.201402962![]()
[6] H. K. Kang and S. S. Kim, J. Korean Inst. Electr. Electron. Mater. Eng., 36, 29 (2023). doi: https://doi.org/10.4313/JKEM.2023.36.1.5![]()
[7] D. M. Moon, D. E. Hyun, J. H. Oh, J. B. Jeon, Y. N. Kim, K. H. Jeong, J. K. Lee, S. M. Koo, D. W. Lee, and J. M. Oh, J. Korean Inst. Electr. Electron. Mater. Eng., 36, 638 (2023). doi: https://doi.org/10.4313/JKEM.2023.36.6.17![]()
[8] S. Shin, H. Cho, Y. J. Jung, S. M. Koo, J. M. Oh, and W. H. Shin, J. Korean Inst. Electr. Electron. Mater. Eng., 36, 10 (2023). doi: https://doi.org/10.4313/JKEM.2023.36.1.2![]()
[9] Y. Kim, M. Kim, T. Lee, E. Kim, M. An, J. Park, J. Cho, and Y. Son, Electrochem. Commun., 147, 107437 (2023). doi: https://doi.org/10.1016/j.elecom.2023.107437![]()
[10] V. Etacheri, R. Marom, R. Elazari, G. Salitra, and D. Aurbach, Energy Environ. Sci., 4, 3243 (2011). doi: https://doi.org/10.1039/C1EE01598B![]()
[11] A. Manthiram, A. Vadivel Murugan, A. Sarkar, and T. Muraliganth, Energy Environ. Sci. 1, 621 (2008). doi: https://doi.org/10.1039/B811802G![]()
[12] H. B. Yahia, M. Shikano, and H. Kobayashi, Chem. Mater., 25, 3687 (2013). doi: https://doi.org/10.1021/cm401942t![]()
[13] Y. Wang, Z. Feng, P. Cui, W. Zhu, Y. Gong, M. A. Girard, G. Lajoie, J. Trottier, Q. Zhang, L. Gu, Y. Wang, W. Zuo, Y. Yang, J. B. Goodenough, and K. Zaghib, Nat. Commun., 12, 13 (2021). doi: https://doi.org/10.1038/s41467-020-20169-1![]()
[14] S. Kalluri, M. Yoon, M. Jo, H. K. Liu, S. X. Dou, J. Cho, and Z. Guo, Adv. Mater., 29, 1605807 (2017). doi: https://doi.org/10.1002/adma.201605807![]()
[15] F. Lin, I. M. Markus, D. Nordlund, T. C. Weng, M. D. Asta, H. L. Xin, and M. M. Doeff, Nat. Commun., 5, 3529 (2014). doi: https://doi.org/10.1038/ncomms4529![]()
[16] J. Kim, H. Ma, H. Cha, H. Lee, J. Sung, M. Seo, P. Oh, M. Park, and J. Cho, Energy Environ. Sci., 11, 1449 (2018). doi: https://doi.org/10.1039/C8EE00155C![]()
[17] H. Kim, M. G. Kim, H. Y. Jeong, H. Nam, and J. Cho, Nano Lett., 15, 2111 (2015). doi: https://doi.org/10.1021/acs.nanolett.5b00045![]()
[18] S. H. Ju, I. S. Kang, Y. S. Lee, W. K. Shin, S. Kim, K. Shin, and D. W. Kim, ACS Appl. Mater. Interfaces, 6, 2546 (2014). doi: https://doi.org/10.1021/am404965p![]()
[19] H. Cha, J. Kim, H. Lee, N. Kim, J. Hwang, J. Sung, M. Yoon, K. Kim, and J. Cho, Adv. Mater., 32, 2003040 (2020). doi: https://doi.org/10.1002/adma.202003040![]()
[20] N. Ikeda, I. Konuma, H. B. Rajendra, T. Aida, and N. Yabuuchi, J. Mater. Chem. A, 9, 15963 (2021). doi: https://doi.org/10.1039/D1TA03066C![]()
[21] A. Mukhopadhyay and B. W. Sheldon, Prog. Mater. Sci., 63, 58 (2014). doi: https://doi.org/10.1016/j.pmatsci.2014.02.001![]()
[22] H. Yu, Y. Qian, M. Otani, D. Tang, S. Guo, Y. Zhu, and H. Zhou, Energy Environ. Sci., 7, 1068 (2014). doi: https://doi.org/10.1039/C3EE42398K![]()
[23] P. Yan, J. Zheng, M. Gu, J. Xiao, J. G. Zhang, and C. M. Wang, Nat. Commun., 8, 14101 (2017). doi: https://doi.org/10.1038/ncomms14101![]()
[24] H. Dong and G. M. Koenig, CrystEngComm, 22, 1514 (2020). doi: https://doi.org/10.1039/C9CE00679F![]()
[25] T. Kauppinen, P. Laine, J. Välikangas, P. Tynjälä, T. Hu, J. Salminen, and U. Lassi, ChemElectroChem, 10, e202300265 (2023). doi: https://doi.org/10.1002/celc.202300265![]()